Índice do Conteúdo
Na quinta-feira (04), o órgão regulador britânico concedeu licença condicional ao comprimido contra a Covid-19 desenvolvido pela Merck Pharmaceuticals (conhecido como MSD no Brasil).
Essa autorização é a primeira no mundo a ser autorizada para o medicamento, e o medicamento ainda está em avaliação por órgãos reguladores dos Estados Unidos e da União Europeia.
Não está claro se a pílula será vendida em farmácias.
De acordo com a agência britânica, o Serviço Nacional de Saúde (NHS) do país vai confirmar como o medicamento será usado nos pacientes.
O medicamento molnupiravir tem o nome comercial Lagevrio no país e está aprovado para uso em pessoas com Covid-19 leve a moderado.
E há pelo menos um fator de risco para doenças graves, incluindo obesidade, idade avançada (acima de 60 anos), diabetes ou doenças cardíacas.
A recomendação da agência reguladora é usar o medicamento o mais rápido possível após um diagnóstico positivo de Covid-19 e dentro de 5 dias após o início dos sintomas.
O remédio
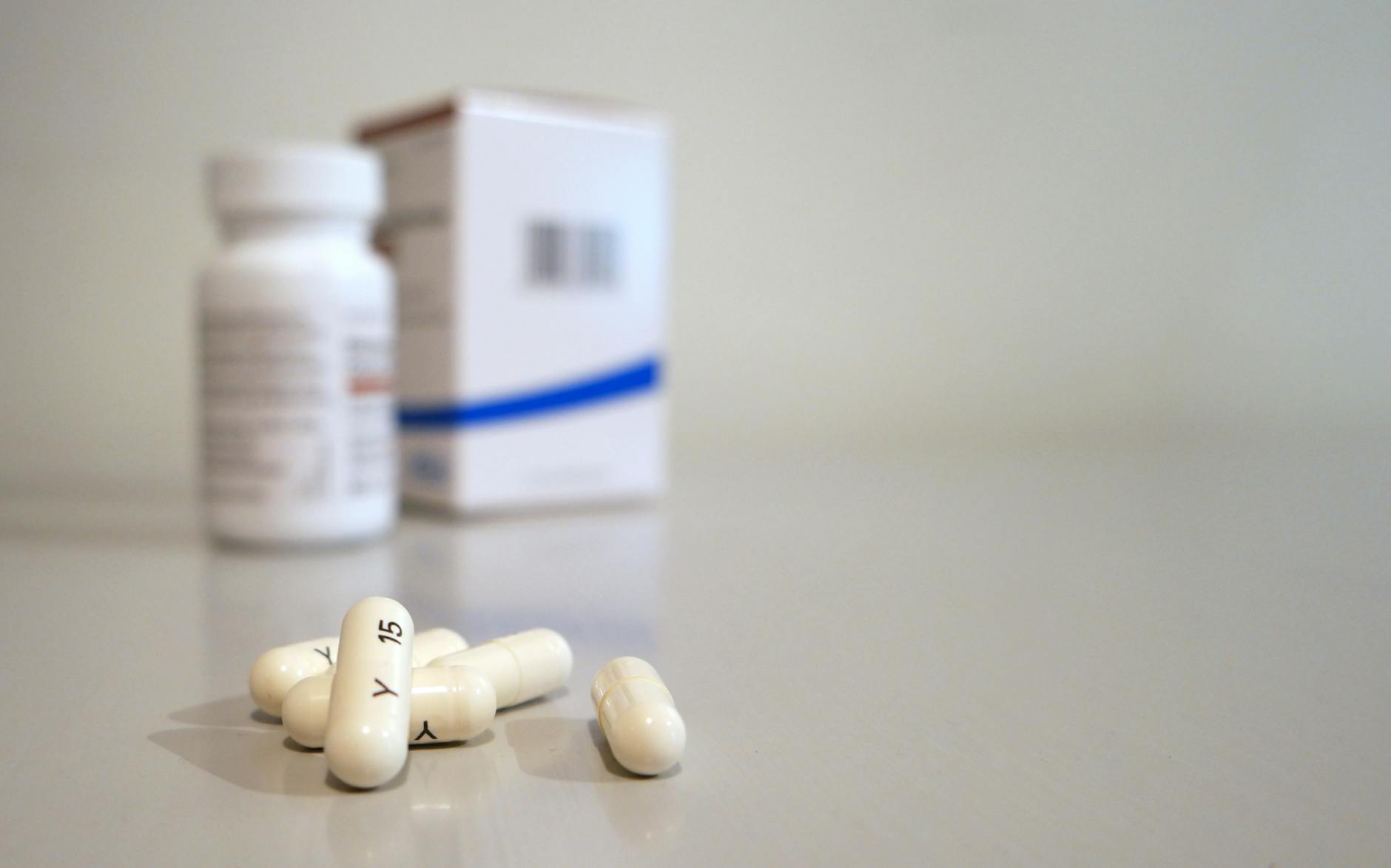
A farmacêutica americana Merck anunciou no início de outubro que seu medicamento experimental contra o Covid-19, o molnupirvir, havia reduzido as hospitalizações e mortes em pessoas no início da infecção com o coronavírus.
Nos estudos, os pacientes que receberam molnupirvir dentro de 5 dias do início dos sintomas de Covid-19 foram hospitalizados pela metade da frequência.
Com exceção das mortes relacionadas a pacientes que recebem pílulas inativas, o medicamento não tem efeito em pacientes com condições graves de Covid-19.
Autorização condicional
Os reguladores britânicos introduziram o programa National Conditional Marketing Authorization (CMA) para novos medicamentos no Reino Unido (Inglaterra, País de Gales e Escócia), que será implementado em 1º de janeiro deste ano.
Uma licença de uso de emergência para molnupiravir foi concedida à Irlanda do Norte para garantir seu uso em todo o Reino Unido.
No entanto, o sistema de autorização condicional é destinado a medicamentos que, portanto, atendem a uma necessidade médica que ainda não foi atendida.
Por exemplo, doenças graves e potencialmente fatais para as quais não existem opções de tratamento satisfatórias. Ou quando o produto oferece um benefício terapêutico importante, No entanto, a Agência pode conceder tal autorização quando os dados clínicos ainda não estiverem completos, No entanto, visto que esses dados estarão disponíveis em breve.


